Wpływ wolnozmiennego pola magnetycznego na leczenie bólu neuropatycznego. Dyskusyjna rola tlenku azotu.
Streszczenie:
Wstęp. Ból neuropatyczny powstaje na skutek uszkodzenia dużych pni nerwowych. Dolegliwościom bólowym towarzyszą zaburzenia wegetatywne i zaburzenia czucia. W powstawaniu wrażeń bólowych i allodynii biorą udział receptory NMDA.
Materiał i metodyka. W badaniu wzięły udział osoby cierpiące z powodu bólu neuropatycznego. Poddane były działaniu pola magnetycznego o niskiej indukcji. Poprawa dolegliwości oceniana była za pomocą Subiektywnej Skali Oceny Dolegliwości, w której maksymalne i rzeczywiste nasilenie dolegliwości oznaczano na poziomie dziesięciu punktów, ustąpienie dolegliwości po leczeniu oceniano na poziomie punktu zerowego.
Wyniki. Stosując magnetostymulację uzyskano poprawę w zakresie bólu neuropatycznego i zaburzeń czucia u wszystkich osób w różnym stopniu. U dwóch osób uzyskano całkowite i trwałe zniesienie bólu i przeczulicy.
Dyskusja. Działanie pola magnetycznego w leczeniu bólu neuropatycznego próbuje się tłumaczyć znanym z magnetobiologii zjawiskiem rezonansu cyklotronowego, wpływem pola magnetycznego na stężenie jonów wapnia aktywujących syntetazę tlenku azotu.
Słowa kluczowe:
magnetostymulacji, ból neuropatyczny, leczenie, tlenek azotu, subiektywna skala oceny dolegliwości SSOD
Autorzy:
ANNA BRYL, HANNA KRAUSS, JANUSZ PALUSZAK, PIOTR KOWAL*, PRZEMYSŁAW SOSNOWSKI, AGNIESZKA ADAMCZAK
Katedra Fizjologii Akademii Medycznej im. Karola Marcinkowskiego w Poznaniu
Kierownik: prof. dr hab. Janusz Paluszak
*Katedra i Klinika Neurologii Akademii Medycznej im. Karola Marcinkowskiego w Poznaniu
Kierownik: prof. dr hab. Wojciech Kozubski
Źródło:
Nowiny Lekarskie 2006,75,4, 315-320
Treść artykułu:
Wstęp
Ból neuropatyczny powstaje po uszkodzeniu włókien nerwowych. W dużej części przypadków powstaje jako skutek obwodowego urazu pnia nerwowego, np. niecałkowitego przerwania nerwu podczas nieumyślnego uszkodzenia operacyjnego, wstrzyknięcia leków lub środków znieczulających. Może towarzyszyć też chorobie nowotworowej w wyniku rozrostu komórek nowotworowych i naciekania w okolicy danego nerwu lub jako efekt radioterapii. Najczęściej uszkodzone są duże pnie nerwowe zawierające włókna współczulne, takie jak nerw pośrodkowy, łokciowy, kulszowy, piszczelowy [1]. Dolegliwości bólowe mają charakter ciągły, przewlekły, są o dużym nasileniu i nierzadko powodują deprywację snu i utrudniając funkcjonowanie w życiu codziennym ze względu na znaczną uciążliwość. Charakter bólu może być różny: szarpiący, piekący, palący z towarzyszącą mu allodynią lub hyperestezją. U podłoża powstawania wrażeń bólowych charakteryzujących ból neuropatyczny tkwi prawdopodobnie szereg mechanizmów prowadzących do długotrwałego pobudzenia włókien C w obrębie rogów tylnych rdzenia kręgowego. Pobudzenie to szczególnie mocno wyrażone jest w przypadku uszkodzenia (np. przecięcia/włókien nerwowych (2-). Uwalniane w zwiększonych ilościach aminokwasy ekscyto-toksyczne (EAA), nadmiernie aktywują receptory NMDA, co wiąże się z powstawaniem reakcji „wind up” we włóknach typu C [3, 4]. Usposabia to do powstania nieprawidłowej reakcji po stymulacji za pomocą bodźców podprogowych i w dalszej kolejności jest jak się przypuszcza jednym z mechanizmów prowadzących do powstawania allodynii. Wiadomo bowiem, że blokada receptorów NMDA z pomocą ketaminy prowadzi do obniżenia wrażliwości uszkodzonych neuronów i zniesienia allodynii [4].
Nadmierna stymulacja receptorów NMDA skutkuje zwiększonym napływem jonów wapnia do komórki, a następnie uaktywnieniem układu drugiego przekaźnika [5].
Materiał i metodyka
Do grupy badanej należały osoby, których dolegliwości bólowe spełniały kryteria bólu nęuropatycznego z towarzyszącymi zaburzeniami czucia oraz objawami autonomicznymi. Uszkodzenie dotyczyło nerwu łokciowego (uraz podczas zabiegu operacyjnego – l osoba), nerwu udowo- goleniowego (1 osoba), nerwu bródkowego (uszkodzenie pourazowe – 1 osoba), nerwu pośrodkowego [1] uszkodzenia nerwu kulszowego (5 osób). Do dolegliwości towarzyszących należały zaburzenia czucia o charakterze allodynii, nadwrażliwości na bodźce temperaturowe, na dotyk, drętwienia.
Osoby te leczone były uprzednio lekami z grupy NLPZ, lekami przeciwdepresyjnymi oraz lekami przeciwpadaczkowymi. Uzyskane za pomocą farmakoterapii wyniki nie były dla pacjentów zadowalające, ponieważ nadal w różnym stopniu utrzymywały się dolegliwości w postaci przeczulicy, drętwień, bólu o charakterze ciągłym lub nasilających się dolegliwości bólowych spowodowanych różnymi bodźcami, w tym bodźcami fizycznymi, takimi jak: bodźce temperaturowe, zmiana pozycji ciała, zmęczenie.
Osoby badane poddawane były zabiegom magnetostymulacji aparatem Viofor, produkcji firmy Med & Life, stosując pole magnetyczne wytwarzane za pomocą systemu IPS sposobem М2, programem P3, przy intensywności wzrastającej w skali umownej od 4 do 6. Oznacza to, że częstotliwość impulsów podstawowych mieściła się w przedziale 180-195 Hz, częstotliwość paczek impulsów w przedziale 12,5 Hz-29 Hz, grup paczek 2,8-7,6 Hz, a serii 0,08-0,3 Hz. Docelowa intensywność pola określana była liczbą 6, co oznacza indukcję skuteczną pola wynoszącą 15 mikroTesli [13]. Używano małego aplikatora, stosując go w miejscach gdzie ból był najbardziej dolegliwy wykonując w czasie jednej sesji trzy aplikacje. Zabiegi wykonywano codziennie z wyjątkiem niedziel, aż do uzyskania poprawy, a następnie wykonywano zabiegi „przypominające” przy nawrotach dolegliwości. Ilość zabiegów wynosiła od 10 do 27.
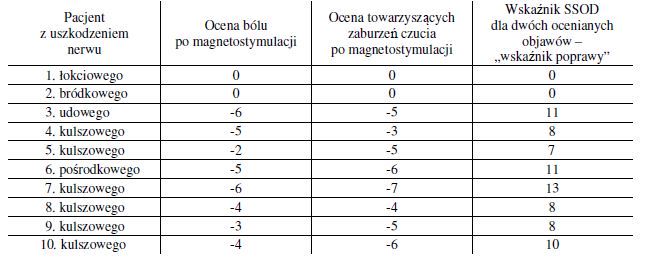
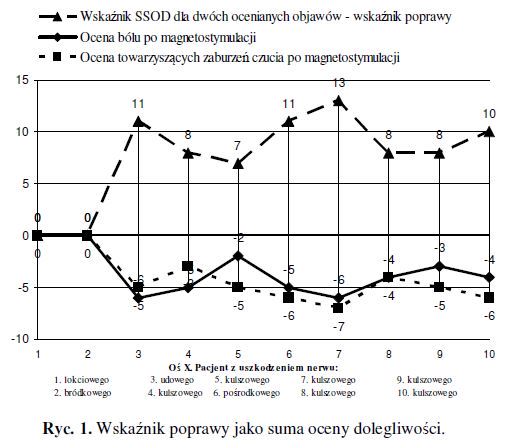
Ocena dolegliwości dokonywana była przez pacjentów za pomocą Subiektywnej Skali Oceny Dolegliwości. Skala ta została stworzona w celu oceny rzeczywistej zmiany samopoczucia. Wg tej skali wartość (-10) punktów określała maksymalne nasilenie rzeczywistych dolegliwości, punkt zerowy oznaczał określenie samopoczucia przed wystąpieniem objawu, tzn. bez ocenianej dolegliwości. Wartość liczbowa stanowiąca wskaźnik poprawy jest sumą wartości bezwzględnych liczb określających zmianę odczuwania ocenianej dolegliwości i objawów towarzyszących przy ocenie dokonywanej osobno dla każdego objawu. Oceniane są dwa lub trzy najbardziej dokuczliwe dla pacjenta objawy – wartość maksymalna wskaźnika wynosi wtedy odpowiednio 20 lub 30 punktów. Im mniejsza wartość liczbowa wskaźnika, tym większa poprawa. Skala ta umożliwia porównanie nasilenia dolegliwości rzeczywistych u danego pacjenta, przed leczeniem i po leczeniu, oraz uwzględnia poprawę, która może obejmować inne objawy niż oceniana główna dolegliwość np. ból. Skala nie określa największego bólu jaki pacjent może sobie wyobrazić, ponieważ nie każda z osób cierpiących może wyobrazić sobie większy ból niż ten, na który cierpi, lub też cierpi na inne silne dolegliwości, przy których oceniania dolegliwość wydaje się błaha. Skala pozwala nie tylko na uwzględnienie skuteczności leczenia, ale i na ocenę dobroczynnego działania danej substancji lub sposobu postępowania na inne objawy oraz ogólne samopoczucie. Nie jest zadaniem autorów skali porównanie dolegliwości występujących u różnych osób, ale ocena nasilenia danej dolegliwości u danej osoby przed i po przeprowadzonym postępowaniu leczniczym.
Wyniki
Ocena dokonywana była po dwóch tygodniach po ukończeniu leczenia. Wyjściową wartością było zawsze (-10). Zauważono, że w pourazowych uszkodzeniach nerwów podczas zabiegów chirurgicznych, początkowo dolegliwości bólowe znacznie nasilały się na początku leczenia, po czym po serii zabiegów okresy bezbólowe były dłuższe niż u innych pacjentów, następnie uzyskano całkowite ustąpienie bólu oraz towarzyszących zaburzeń czucia. U pacjentów, którzy cierpieli z powodu uszkodzenia nerwu kulszowego, w przebiegu chorób krążka międzykręgowego ostateczna poprawa w zakresie dolegliwości bólowych i zaburzeń czucia była mniejsza, ale zaostrzenie dolegliwości również nie wystąpiło tak gwałtownie.
Dyskusja
Wyjaśnienie zasady działania przeciwbólowego pola magnetycznego o niskiej indukcji w leczeniu bólu neuropatycznego jest trudne. Poza lekami antydepresyjnymi pacjenci leczeni byli za pomocą leków przeciwpadaczkowych, tj. pochodnymi kwasu walproinowego, oraz gabapentyną oraz topiramatem. Mechanizm działania tych leków opiera się na wybiórczym zwiększeniu stężenia GAB A w synapsach, zahamowaniu wychwytu komórkowego przez komórki glejowe, zwiększeniu przewodnictwa dla jonów potasu poprzez receptory GABAA, co prowadzi do hiperpolaryzacji błony neuronalnej oraz na hamowaniu bramkowanych napięciem kanałów wapniowych, typu alfa2-delta, na błonie komórkowej neuronu. W przypadku gabapentyny, która stanowi analog kwasu gamma-amino-masłowego w grę wchodzi jeszcze możliwość innych oddziaływań tego związku. Topiramat blokuje receptory glutaminergiczne AMPA-kainowe oraz dodatkowo blokuje przewodnictwo dla jonów sodu i zwiększa prąd potasowy poprzez receptory GABAa [6]- Niestety za pomocą tych leków nie uzyskano zadowalającego efektu terapeutycznego, mimo zmniejszenia natężenia bólu. Było to powodem wykorzystania magneto- stymulacji jako dodatkowej metody, mającej wpływ na mechanizmy błonowe i przekaźnictwo jonowe.
Wydaje się, że oddziaływanie magnetostymulacji na przekaźnictwo bólowe w bólu neuropatycznym jest dość złożony. Skutek działania pola magnetycznego przypomina
w tym wypadku działanie hamujące przewodnictwo glutaminergiczne w obrębie uszkodzonych neuronów, z następowym zapobieganiem powstawaniu przedłużonej depolaryzacji, ponieważ wpływa na zmniejszenie objawów bólowych oraz na zmniejszenie zaburzeń czuciowych. Poprawa w zakresie tych objawów obejmowała coraz dłuższe okresy czasu po aplikacji pola magnetycznego. Wiadome jest, że hamowanie receptora NMDA zachodzi przy pomocy antagonistów oddziaływujących na różne miejsca rozpoznawcze receptora NMDA. O ile antagoniści bezkompetycyjni receptora NMDA, do których należą związki takie jak memantyna, ketamina czy amantadyna są blokerami działającymi bezpośrednio na kanał jonowy receptora NMDA, to wydaje się, że stymulacyjny wpływ pola magnetycznego zachodzi również za pomocą innych mechanizmów [11].
Mechanizm bezkompetycyjnego blokowania kanału jonowego możliwy jest po zniesieniu bloku magnezowego. Zachodzi on w przypadku zaistnienia poprzedzającej go częściowej depolaryzacji. Powoduje ona pobudzenie receptorów AMPA i otwarcie kanałów sodowych. Wiadomo jest, że kanały receptora NMDA nie posiadają mechanizmu zamykającego w postaci potencjału inaktywacji jonowej [11]. Dlatego możliwe jest, że dopóki aminokwasy pobudzające nie zostaną pobrane w mechanizmie wychwytu neuronalnego neuron presynaptyczny lub przez komórki glejowe, zgromadzone będą one w pobliżu miejsc wiązań receptorowych i w konsekwencji uruchomią mechanizmy prowadzące do napływu jonów wapniowych dokomórkowo.
Wydaje się, że analgetyczny wpływ zmiennego pola magnetycznego o niskiej indukcji wiąże się również z innymi mechanizmami hamowania receptora NMDA niż hamowanie kanału jonowego, ponieważ uzyskane za jego pomocą długotrwałe działanie analgetyczne znacznie różni się od przemijającego efektu działania ketaminy. Z dostępnego piśmiennictwa bowiem wiadomo, że po zaprzestaniu podawania ketaminy ból powracał z taką samą intensywnością [4]. Natomiast u ww. pacjentów po ekspozycji na pole magnetyczne najpierw natężenie bólu na krótko rosło, potem malało, a następnie u niektórych pacjentów ból ustępował na coraz dłuższe okresy do uzyskania całkowitego ustąpienia dolegliwości.
Próbę obserwowanego, długotrwałego efektu analge- tycznego powstałego pod wpływem zmiennego pola magnetycznego o niskiej indukcji można starać się wyjaśnić w oparciu o model jonowego rezonansu cyklotronowego [7], którego szczególne znaczenie kliniczne potwierdzają twórcy urządzenia. Według teorii wykorzystującej ten model w magnetobiologii jony wapnia stanowią główny cel oddziaływania pola magnetycznego w obrębie błon komórkowych i cytosolu. Zmiany stężenia jonów wapnia w komórce oraz zmiany transportu jonowego zależą od parametrów zastosowanego pola magnetycznego i wyjściowego poziomu wapnia wewnątrzkomórkowego [7]. Badania aktywności enzymów błonowych i procesów transportu jonów wapnia pod wpływem zmiennego pola magnetycznego wskazują na obecność zmian stężenia wewnątrzkomórkowego wapnia [7, 15]. Od stężenia wapnia zależy zmiana polaryzacji błony komórkowej w kierunku długotrwałego wzmocnienia synaptycznego lub długotrwałego osłabienia synaptycznego, a co za tym idzie określa spadek lub wzrost reaktywności komórki [8]. Należy się zastanowić czy zmiany odczuwania bólu podczas zabiegu i po zabiegach magnetostymulacji nie są z tym zjawiskiem związane.
Przypomina to bowiem zjawisko hormezy, w którym obserwuje się przeciwstawne reakcje komórkowe w zależności od stężenia substancji działającej na daną komórkę. Wydaje się, że w przypadku działania pól magnetycznych zachodzić również zjawisko pośredniego oddziaływania na receptor NMDA. Czynnikiem modyfikującym pobudliwość receptora może tu również być tlenek azotu, który poprzez oddziaływanie na miejsce glicynowe receptora NMDA pełniłby on tutaj rolę regulującą pobudliwość komórki [8]. Działanie tlenku azotu jako neurotransmitera opiera się na aktywacji cyklazy guanyzylowej oraz na hiperpolaryzacji błony komórkowej poprzez otwarcie kanałów dla jonów potasu [11].
Jak wiadomo tlenek azotu powstaje z L-argininy przy udziale syntetazy tlenku azotu neuronalnej (nNOS) oraz syntetazy tlenku azotu indukowanej (iNOS). Są one aktywowane przez zwiększenie stężenia jonów wapnia na skutek pobudzenia receptorów NMDA [14]. Jak stwierdzono w badaniach wykonanych na zwierzętach, uszkodzenie nerwu obwodowego i idąca za tym aktywacja indukowanej syntetazy tlenku azotu mają znaczenie w patogenezie bólu neuropatycznego i powstawaniu hiperalgezji. Dokładne mechanizmy wpływu denku azotu na powstawanie bólu neuropatycznego nie są znane i wśród autorów w dostępnym piśmiennictwie oceniane niejednoznacznie, co być może zależy od parametrów aplikowanego pola magnetycznego, ponieważ w niektórych pracach przy podobnie niskich indukcjach pola magnetycznego stosowano sygnał o kilkukrotnie niższej częstotliwości niż w naszej pracy [16, 17, 18]. Przypuszcza się, że proces hamowania lub pobudzania rozpoczyna się w neuronie postsynaptycznym i jest zainicjowany przez jony wapnia, które łącząc się z kalmoduliną aktywują syntazę tlenku azotu. Tlenek azotu, w przeciwieństwie do innych neurotransmiterów może drogą dyfuzji przemieszczać się w kierunku wstecznym, tj. do synapsy glutaminergicznej. Skutkiem tego jest zwiększenie przewodnictwa glutaminergicznego oraz wzrost aktywności procesów prooksydacyjnych o charakterze neurotoksycznym. Hamowanie syntazy denku azotu przez oddziaływanie pola magnetycznego na komórkę nerwową ma więc działanie neuroprotekcyjne oraz prawdopodobnie wpływa na zahamowanie procesów długotrwałego wzmocnienia synaptycznego. Zahamowanie syntezy tlenku azotu stwierdzono badając wpływ wolnozmiennych pól magnetycznych na procesy energetyczne w mózgu szczurów [19]. Nawiązując ponownie do rezonansu cyklotronowego i do regulacji stężenia wapnia pod wpływem pola magnetycznego o niskiej indukcji, należy się zastanowić czy mechanizm ten nie wiąże się z hamowaniem syntetazy tlenku azotu poprzez zmniejszenie stężenia jonów wapniowych lub oddziaływanie na wiązanie wapnia z kalmoduliną [15]. Zjawisko to może być podstawą działania przeciwbólowego magneto- stymulacji oraz tłumaczyć całkowite zniesienie lub zmniejszenie zaburzeń czucia o typie hiperalgezji.
Literatura:
- Domżał T.M.: Nerwobóle. Wydawnictwo Czelej, Lublin 2003,24-28.
- Zhang M., Zhou LJ., Hu X.D., Hu N.W., Zhang T., Iiu X.G.: Acute nerve injury induces long-term potentiation of C- fiber evoked field potentials in spinal dorsal hom of intact rat. Sheng Li Xue Bao., 2004,56,5,591-6 (abstrakt).
- Baczyk E., Łuczak , Kotlińska-Lemieszek A.: Patomechanizm i leczenie bólu neuropatycznego. Nowa Med.,1999,6, 8, 41-44.
- (Umstelle L.M.: Bon and John Garthwaite On the Role of Nitric Oxide in Hippocampal Long-Term Potentiation. Neurosci.., 2003,23,5,1941.
- Choi D.: Ketamine reduces NMDA receptor mediated neurotoxicity in cortical cultures. Status of Ketamine in Anesthesiology, 1990, NPP Books edited by E.F. Domino, s. 549-555.
- Jędrzejczak , Zwoliński P.: Nowe leki przeciwpadaczkowe. Fundacja Epileptologii, Warszawa 2000.
- Iiboff R.: Cyclotron rezonanse in membrane transport Plenum publishing Со, 281-296,1985.
- Tenforde TS:Biological interactions of extremely low frequency electric and magnetic fields. Bioenerg., 1991,25,1-17.
- Eide K., Stubhaug A., Stenehejn E.A: Central dysesthesia pain after traumatic spinal cord injury is dependent on N- methyl-D-aspartate receptor activation. Neurosurgery, 1995, 37,1080-1087.
- Sieroń A.: Zastosowanie pól magnetycznych w medycynie. A-medica press 2002,190-194.
- Jerzy Z Nowak, Jolanta B. Zawilska: Receptory, struktura, charakterystyka, funkcja. Wydawnictwo Naukowe PWN, Warszawa 1997,166-167.
- Sorrentino D.F., Fritz K.I., Haider S.R, Parikh N., Papadopoulos M.D., Mishra O.P.: Nitric oxide-mediated modification of the glycine binding site of the NMDA receptor during hypoxia in the cerebral cortex of the newborn piglet. Neurochem. Res., 2004,29,2,455-9.

